Cmv Igg: Định Lượng Kháng Thể Igg Kháng Cytomegalovirus...
Liên hệ
Hà Nội

CMV IgG (IgG antibodies to Cytomegalovirus)
Hóa chất có thể được sử dụng trên máy: Elecsys 2010, Modular analytics E170, cobas e 411, cobas e 601
Mục đích sử dụng
Xét nghiệm miễn dịch in vitro dùng để định lượng kháng thể IgG kháng cytomegalovirus trong huyết thanh và huyết tương người.
Kết quả xét nghiệm này được dùng để xác định đã từng nhiễm hay mới nhiễm CMV.
Xét nghiệm miễn dịch điện hóa phát quang “ECLIA” được dùng cho các máy xét nghiệm miễn dịch Elecsys và cobas e.
Tóm tắt
Cytomegalovirus, một dòng của họ herpes vi rút, tồn tại trong mọi chủng tộc người, gây ra các nhiễm trùng tiếp nối bởi thời gian tiềm ẩn kéo dài ở ký chủ với thỉnh thoảng có những thời kỳ tái kích hoạt cũng như tái nhiễm.
Tần suất kháng thể trong huyết thanh ở người lớn dao động trong khoảng 40-100 % và có mối tương quan nghịch với tình trạng kinh tế xã hội. Việc lây nhiễm đòi hỏi sự tiếp xúc trực tiếp với các dịch tiết bị nhiễm như nước bọt, nước tiểu, dịch tiết ở cổ tử cung và âm đạo, tinh dịch, sữa mẹ và máu.
Nhiễm CMV thường nhẹ và không có triệu chứng. Tuy nhiên, nhiễm CMV nguyên phát ở người mẹ mang thai có nguy cơ lây nhiễm cao ở tử cung gây ra tổn thương nghiêm trọng cho bào thai như chậm phát triển thể chất và tâm thần, vàng da và các bất thường hệ thần kinh trung ương.
Những thai không có triệu chứng lúc sinh vẫn có thể phát triển các khuyết tật về thính giác hoặc các bất thường về học tập ở cuộc sống sau này.
Nguy cơ nhiễm CMV trước khi sinh là khoảng 0.2-2.5 %.
Khoảng 10 % số phụ nữ có huyết thanh dương tính sẽ tái kích hoạt CMV trong quá trình mang thai, nhưng tỷ lệ lây truyền sang bào thai chỉ khoảng 1% trong nhóm bị nhiễm thứ phát so với 40 % ở nhóm bị nhiễm nguyên phát. Sau một đợt nhiễm nguyên phát CMV, cá thể có thể bị tái nhiễm do vi rút ngoại sinh hoặc do sự tái kích hoạt của vi rút tiềm ẩn.
Những đối tượng có nguy cơ bị nhiễm CMV nặng là các bệnh nhân hệ miễn dịch thỏa hiệp như bệnh nhân được cấy ghép cơ quan và bệnh nhân nhiễm HIV mà ở đó vi rút có thể gây đe dọa tính mạng. Với những bệnh nhân này, phải cung cấp các chế phẩm từ máu có huyết thanh âm tính. Có thể sử dụng các xét nghiệm huyết thanh học để xác định huyết thanh âm tính của những người hiến máu hoặc các sản phẩm từ máu. Định lượng kháng thể IgG kháng CMV được dùng để đánh giá tình trạng huyết thanh của một cá nhân và cũng là chỉ dẫn tình trạng nhiễm cấp tính hay đã từng nhiễm.
Bước đầu tiên thông thường nhất trong chẩn đoán nhiễm CMV nguyên phát cấp tính là phát hiện kháng thể IgG và IgM đặc hiệu kháng CMV. Các mẫu có kháng thể IgM cho phản ứng chỉ dẫn tình trạng nhiễm CMV cấp, vừa mới nhiễm hay tái nhiễm. Để phân tích thêm tình trạng nhiễm CMV nguyên phát, cần thực hiện xét nghiệm bổ trợ là xác định ái lực của kháng thể IgG kháng CMV. Kết quả IgM dương tính kết hợp với chỉ số ái lực thấp của IgG là một chỉ dẫn quan trọng cho biết nhiễm CMV nguyên phát trong vòng 4 tháng gần nhất. Chuyển đoạn huyết thanh của kháng thể IgM và IgG kháng CMV cũng chẩn đoán cho tình trạng mới nhiễm CMV.
Nguyên lý xét nghiệm
Nguyên lý bắt cặp. Tổng thời gian xét nghiệm: 18 phút.
• Thời kỳ ủ đầu tiên: 20 μL mẫu thử, kháng nguyên tái tổ hợp đặc hiệu CMV đánh dấu biotin, và kháng nguyên tái tổ hợp đặc hiệu CMV đánh dấu phức hợp rutheniuma tạo thành phức hợp bắt cặp.
• Thời kỳ ủ thứ hai: Sau khi thêm các vi hạt phủ streptavidin, phức hợp miễn dịch trên trở nên gắn kết với pha rắn thông qua sự tương tác giữa biotin và streptavidin.
• Hỗn hợp phản ứng được chuyển tới buồng đo, ở đó các vi hạt đối từ được bắt giữ trên bề mặt của điện cực. Những thành phần không gắn kết sẽ bị thải ra ngoài buồng đo bởi dung dịch ProCell/ProCell M. Cho điện áp vào điện cực sẽ tạo nên sự phát quang hóa học được đo bằng bộ khuếch đại quang tử.
• Các kết quả được xác định thông qua một đường chuẩn xét nghiệm trên máy được tạo nên bởi xét nghiệm 2 điểm chuẩn và thông tin đường chuẩn chính qua mã vạch trên hộp thuốc thử.
Thuốc thử - dung dịch tham gia xét nghiệm
Bộ thuốc thử (M, R1, R2) được dán nhãn CMVIGG.
M Vi hạt phủ Streptavidin (nắp trong), 1 chai, 6.5 mL: Vi hạt phủ Streptavidin 0.72 mg/mL; chất bảo quản.
R1 CMV-Ag~biotin (nắp xám), 1 chai, 9 mL: Kháng nguyên đặc hiệu CMV đánh dấu biotin (tái tổ hợp, E. coli), > 400 μg/L, đệm MES 50 mmol/L, pH 6.5; chất bảo quản.
R2 CMV-Ag~Ru(bpy)2+3 (nắp đen), 1 chai, 9 mL: Kháng nguyên đặc hiệu CMV (tái tổ hợp, E. coli) đánh dấu phức hợp
ruthenium > 400 μg/L; đệm MES 50 mmol/L, pH 6.5; chất bảo quản.
CMVIGG Cal1 Mẫu chuẩn âm tính 1 (nắp trắng), 2 chai, mỗi chai 1.0 mL: Huyết thanh người, không phản ứng với kháng thể IgG kháng CMV; đệm; chất bảo quản.
CMVIGG Cal2 Mẫu chuẩn dương tính 2 (nắp đen), 2 chai, mỗi chai 1.0 mL: Huyết thanh người, phản ứng với kháng thể IgG kháng CMV, khoảng 40 U/mL; đệm; chất bảo quản.
Thận trọng và cảnh báo
Dùng trong chẩn đoán in vitro.
Áp dụng các cảnh báo thông thường cần thiết cho việc xử lý các loại thuốc thử phòng thí nghiệm.
Loại bỏ các chất thải tuân theo hướng dẫn của địa phương.
Bảng dữ liệu an toàn hóa chất có sẵn để cung cấp cho chuyên viên sử dụng khi có yêu cầu.
Tất cả các sản phẩm từ người đều có khả năng lây nhiễm.
Cả hai mẫu chuẩn (CMVIGG Cal1, CMVIGG Cal2) đều đã chuẩn bị kỹ từ máu của những người hiến máu đã được xét nghiệm riêng lẻ và cho kết quả âm tính với HBsAg và kháng thể kháng HCV và HIV.
Huyết thanh chứa kháng thể IgG kháng CMV (CMVIGG Cal2) đã được lọc vô trùng.
Các phương pháp xét nghiệm được sử dụng đều đã được FDA chấp thuận hay đã đáp ứng Chỉ thị Châu Âu 98/79/EC, Phụ lục II, Danh mục A.
Tuy nhiên, không có phương pháp xét nghiệm nào có thể loại bỏ hoàn toàn nguy cơ lây nhiễm một cách chắc chắn tuyệt đối, nên xử lý cẩn thận như mẫu bệnh phẩm. Trong trường hợp có phơi nhiễm, nên tuân theo hướng dẫn của cơ quan y tế địa phương.
Không nên sử dụng thuốc thử đã hết hạn sử dụng.
Tránh để các dung dịch thuốc thử và các mẫu (mẫu xét nghiệm, mẫu chuẩn và mẫu chứng) bị tạo bọt.
Sử dụng thuốc thử
Thuốc thử trong hộp thuốc thử sẵn sàng để sử dụng và được cung cấp trong các chai tương thích với hệ thống.
Máy phân tích Elecsys 2010 và cobas e 411: Các mẫu chuẩn phải đưa về nhiệt độ 20-25 °C trước khi đặt trên thiết bị phân tích để chuẩn.
Sau khi sử dụng, đóng ngay nắp chai lại và bảo quản ở 2-8 °C. Do có khả năng xảy ra các hiệu ứng bay hơi, không được thực hiện quá 5 lần quy trình chuẩn trên mỗi bộ chai mẫu chuẩn.
Máy phân tích MODULAR ANALYTICS E170, cobas e 601 và cobas e 602: Ngoại trừ trường hợp cần sử dụng toàn bộ thể tích để chuẩn trên thiết bị phân tích, thông thường nên chuyển phần mẫu chuẩn phụ sẵn sàng để sử dụng vào những chai trống có nắp bật (CalSet Vials). Dán nhãn cho các chai phụ. Bảo quản chai phụ ở 2-8 °C để sử dụng sau này.
Chỉ thực hiện một quy trình chuẩn đối với mỗi chai chuẩn phụ.
Máy phân tích tự động đọc mã vạch trên nhãn thuốc thử và ghi nhận tất cả thông tin cần thiết cho việc chạy thuốc thử.
Bảo quản và độ ổn định
Bảo quản ở 2-8 °C. Không trữ đông.
Đặt hộp thuốc thử Elecsys theo hướń g thẳng đứng nhằm đảm bảo tính hữu dụng của toàn bộ các vi hạt trong khi trộn tự động trước khi sử dụng.
Độ ổn định:
Độ ổn định của bộ thuốc thử
- chưa mở nắp ở 2-8 °C đến ngày hết hạn sử dụng
- sau khi mở và để ở 2-8 °C 12 tuần
- trên máy MODULAR ANALYTICS E170, Elecsys 2010 và cobas e 3 tuần
Độ ổn định của mẫu chuẩn
chưa mở nắp ở 2-8 °C đến ngày hết hạn sử dụng
sau khi mở và để ở 2-8 °C 8 tuần
trên máy Elecsys 2010 và cobas e 411 ở 20-25 °C đến 5 giờ
trên máy MODULAR ANALYTICS E170, cobas e 601 và cobas e 602 chỉ dùng một lần
Bảo quản mẫu chuẩn theo hướng thẳng đứng để tránh dung dịch mẫu chuẩn dính vào nắp bật.
Lấy và chuẩn bị mẫu
Chỉ những mẫu được liệt kê dưới đây đã được thử nghiệm với số lượng đầy đủ và được chấp nhận.
Huyết thanh được lấy bằng cách sử dụng các ống chuẩn lấy mẫu hoặc các ống chứa gel tách.
Huyết tương chống đông bằng Li-heparin, K2-EDTA và K3-EDTA.
Tiêu chuẩn: Độ phục hồi trung bình của mẫu dương tính trong khoảng 80-120 % giá trị huyết thanh.
Mẫu ổn định trong 4 tuần ở 2-8 °C, 7 ngày ở 25 °C, 6 tháng ở -20 °C. Mẫu có thể được giải đông 5 lần.
Các loại mẫu phẩm được liệt kê đã được thử nghiệm cùng với bộ các ống nghiệm lấy mẫu chọn lọc, có bán trên thị trường vào thời điểm xét nghiệm, ngh˜ia là không phải tất cả các ống lấy mẫu của các nhà sản xuất đều được thử nghiệm. Các bộ ống chứa mẫu của các nhà sản xuất khác nhau có thể làm từ những vật liệu khác nhau có khả năng ảnh hưởng đến kết quả xét nghiệm trong một số trường hợp. Khi xử lý mẫu trong các ống chính (ống chứa mẫu), phải tuân theo hướng dẫn của nhà sản xuất ống.
Các mẫu không nên bị biến đổi bởi các chất phụ thêm vào (biocide, chất chống oxy hóa hoặc các chất có khả năng làm thay đổi pH của mẫu) để tránh làm sai số các kết quả.
Các mẫu gộp và nguyên liệu nhân tạo khác có thể có hiệu ứng khác nhau trên các xét nghiệm khác nhau và do đó có thể dẫn đến các kết quả trái ngược.
Ly tâm các mẫu có kết tủa và mẫu đông lạnh trước khi thực hiện xét nghiệm.
Có thể sử dụng các mẫu đông khô và các mẫu bị bất hoạt bởi nhiệt.
Đảm bảo nhiệt độ của các mẫu bệnh phẩm, mẫu chuẩn và mẫu chứng ở 20-25 °C trước khi tiến hành đo.
Do có khả năng xảy ra các hiệu ứng bay hơi, các mẫu bệnh phẩm và mẫu chuẩn trên các thiết bị phân tích phải được đo trong vòng 2 giờ.
Vật liệu cung cấp
Xem phần “Thuốc thử - dung dịch tham gia xét nghiệm” mục thuốc thử.
Vật liệu cần thiết (không cung cấp sẵn)
• REF 04784600190, PreciControl CMV IgG, 8 x 1 mL cho mỗi PreciControl CMV IgG 1 và 2
• REF 11732277122, Diluent Universal, 2 x 16 mL dung dịch pha loãng mẫu hoặc
• REF 03183971122, Diluent Universal, 2 x 36 mL dung dịch pha loãng mẫu
• REF 11776576322, CalSet Vials, 2 x 56 chai trống có nắp bật
• Trang thiết bị thông thường của phòng thí nghiệm
• Máy phân tích Elecsys 2010, MODULAR ANALYTICS E170 hay cobas e
Các phụ kiện cho máy phân tích Elecsys 2010 và cobas e 411:
• REF 11662988122, ProCell, 6 x 380 mL dung dịch đệm
• REF 11662970122, CleanCell, 6 x 380 mL dung dịch rửa buồng đo
• REF 11930346122, Elecsys SysWash, 1 x 500 mL hóa chất rửa pha với nước
• REF 11933159001, Adapter cho SysClean
• REF 11706802001, Elecsys 2010 AssayCup, 60 x 60 cốc phản ứng
• REF 11706799001, Elecsys 2010 AssayTip, 30 x 120 đầu pipette
Các phụ kiện cho máy phân tích MODULAR ANALYTICS E170, cobas e 601 và cobas e 602:
• REF 04880340190, ProCell M, 2 x 2 L dung dịch đệm
• REF 04880293190, CleanCell M, 2 x 2 L dung dịch rửa buồng đo
• REF 03023141001, PC/CC-Cups, 12 cốc để làm ấm ProCell M và CleanCell M trước khi sử dụng
• REF 03005712190, ProbeWash M, 12 x 70 mL dung dịch rửa dùng sau khi chạy mẫu xong và khi thay đổi thuốc thử
• REF 12102137001, AssayTip/AssayCup Combimagazine M, 48 khay x 84 cốc phản ứng hay đầu pipette, túi đựng rác
• REF 03023150001, WasteLiner, túi đựng rác
• REF 03027651001, Adapter M cho SysClean
Các phụ kiện chung cho tất cả máy phân tích:
• REF 11298500316, Elecsys SysClean, 5 x 100 mL dung dịch rửa hệ thống
Xét nghiệm
Để tối ưu hiệu năng xét nghiệm, nên tuân theo hướng dẫn trong tài liệu này cho các máy tương ứng. Tham khảo hướng dẫn vận hành cho từng xét nghiệm đặc hiệu tương ứng.
Thiết bị tự động trộn các vi hạt trước khi sử dụng. Máy đọc thông số đặc hiệu của xét nghiệm trên mã vạch của thuốc thử. Trong trường hợp ngoại lệ nếu máy không đọc được mã vạch, hãy nhập chuỗi 15 con số vào.
Đưa thuốc thử đang lạnh về khoảng 20 °C và đặt vào khay chứa thuốc thử (20 °C) trên máy phân tích. Tránh tạo bọt. Hệ thống sẽ tự động điều hòa nhiệt độ của thuốc thử và đóng/mở nắp chai.
Đặt mẫu chuẩn lên vùng đặt mẫu. Máy phân tích tự động ghi nhận tất cả thông tin cần thiết cho việc chuẩn xét nghiệm. Sau khi hoàn thành chuẩn, lưu trữ các mẫu chuẩn ở 2-8 °C hoặc loại bỏ chúng (máy phân tích MODULAR ANALYTICS E170, cobas e 601 và cobas e 602).
Chuẩn
Thông tin ghi nhận dữ liệu: Phương pháp này đã được chuẩn hóa theo tiêu chuẩn nội bộ của Roche cho CMV IgG. Không có tiêu chuẩn quốc tế nào cho CMV.
Nhãn của từng hộp thuốc thử có mã vạch chứa các thông tin đặc hiệu để chuẩn cho từng lô thuốc thử riêng biệt. Đường chuẩn chính đã được xác định trước sẽ được tái lập trên máy phân tích bằng cách dùng chất chuẩn CMVIGG Cal1 và CMVIGG Cal2.
Tần suất chuẩn định: Cần thực hiện chuẩn mỗi lô thuốc thử sử dụng CMVIGG Cal1, CMVIGG Cal2, và hộp thuốc thử mới (ngh˜ia là không quá 24 giờ từ khi hộp thuốc thử được đăng ký trên máy phân tích).
Thực hiện chuẩn lại khi:
• sau 1 tháng (28 ngày) nếu sử dụng các hộp thuốc thử cùng lô
• sau 7 ngày (nếu sử dụng cùng hộp thuốc thử đó)
• khi cần thiết: ví dụ: khi kết quả mẫu chứng PreciControl CMV IgG nằm ngoài thang
• thường xuyên hơn khi có các quy định liên quan
Kiểm tra chất lượng
Để kiểm tra chất lượng, sử dụng PreciControl CMV IgG.
Chạy các mẫu chứng với nồng độ khác nhau tối thiểu là một lần cho mỗi 24 giờ khi xét nghiệm vẫn đang sử dụng, một lần với mỗi hộp thuốc thử và sau mỗi lần chuẩn. Khoảng cách giữa các lần chạy mẫu chứng và giá trị giới hạn nên tùy thuộc vào yêu cầu riêng của từng phòng thí nghiệm. Kết quả đo phải nằm trong giới hạn cho phép. Mỗi phòng xét nghiệm nên thiết lập các biện pháp hiệu chỉnh khi các giá trị mẫu chứng nằm ngoài thang đo.
Nếu cần, tiến hành đo lại các mẫu có liên quan.
Tuân thủ các quy định chính phủ và hướng dẫn của địa phương về kiểm tra chất lượng.
Lưu ý: Mẫu chứng không có nhãn mã vạch và do đó xét nghiệm mẫu chứng trên tất cả các máy giống như xét nghiệm mẫu chứng không phải của Roche. Giá trị và khoảng giới hạn mẫu chứng phải được nhập thủ công.
Vui lòng tham khảo mục tương ứng trong hướng dẫn vận hành.
Giá trị đích và khoảng giới hạn chính xác đặc hiệu cho từng lô được in trên tờ giá trị đính kèm trong hộp mẫu chứng hoặc hộp thuốc thử (hoặc dưới dạng văn bản điện tử).
Tính toán
Máy phân tích tự động tính toán nồng độ chất phân tích trong mỗi mẫu đo dưới dạng U/mL.
Biện luận kết quả
Kết quả thu được với xét nghiệm Elecsys CMV IgG được biện luận như sau:
Không phản ứng: < 0.5 U/mL
Vô định: 0.5 - < 1.0 U/mL
Có phản ứng: ≥ 1.0 U/mL
Mẫu có nồng độ < 0.5 U/mL được xem như không có phản ứng trong xét nghiệm Elecsys CMV IgG. Những người này được xem như không bị nhiễm CMV và vì thế có nguy cơ nhiễm trùng nguyên phát.
Mẫu có nồng độ trong khoảng 0.5 U/mL và < 1.0 U/mL được xem là vô định. Các mẫu này phải được xét nghiệm lại. Trong trường hợp kết quả vẫn vô định, nên lấy mẫu thứ hai, ví dụ trong vòng 2 tuần.
Mẫu có nồng độ ≥ 1.0 U/mL được xem dương tính với kháng thể IgG kháng CMV và cho biết tình trạng nhiễm trùng cấp hoặc đã từng nhiễm.
Những người này có nguy cơ tiềm tàng lây nhiễm vi rút (ví dụ người mẹ cho bào thai) nhưng hiện tại không nhất thiết gây truyền nhiễm.
Để chẩn đoán nhiễm CMV cấp tính, cần thực hiện thêm các xét nghiệm khác ví dụ định lượng kháng thể IgM kháng CMV và ái lực của kháng thể IgG kháng CMV. Kết quả IgM dương tính kết hợp với chỉ số ái lực thấp của IgG là một chỉ dẫn chắc chắn cho biết nhiễm CMV nguyên phát trong vòng 4 tháng gần nhất.
Chẩn đoán có thể được củng cố bởi sự tăng có ý ngh˜ia nồng độ kháng thể IgG kháng CMV giữa lần lấy mẫu đầu tiên và lần lấy mẫu thứ hai, ví dụ trong vòng 3-4 tuần.
Lưu ý:
Một kết quả vô định hoặc dương tính yếu có thể chỉ dẫn cho nhiễm CMV cấp sớm (cũng như mẫu không có phảnứng với kháng thể IgM kháng CMV).
Kết quả kháng thể IgG kháng CMV của mẫu, được xác định bởi các xét nghiệm của các nhà sản xuất khác nhau, có thể thay đổi do sự khác biệt trong phương pháp xét nghiệm và thuốc thử. Do đó phiếu kết quả xét nghiệm gửi tới bác sỹ phải ghi rõ: "Kết quả dưới đây thu được từ xét nghiệm Elecsys CMV IgG. Kết quả đo từ các xét nghiệm của các nhà sản xuất khác không thể sử dụng để hoán đổi cho nhau."
Yếu tố hạn chế - ảnh hưởng
Một kết quả xét nghiệm âm tính không loại trừ hoàn toàn khả năng nhiễm CMV. Bệnh nhân có thể không biểu hiện kháng thể IgG trong giai đoạn sớm của nhiễm trùng cấp.
Việc phát hiện kháng thể IgG đặc hiệu CMV trong mẫu đơn cho biết tình trạng đã từng phơi nhiễm với CMV trước đó nhưng không luôn đủ để phân biệt tình trạng nhiễm cấp tính hay tiềm ẩn (bất kể nồng độ kháng thể IgG).
Trong một số hiếm trường hợp nhiễm CMV nguyên phát, kháng thể IgG có thể hiện diện trước khi phát hiện kháng thể đặc hiệu IgM. Khuyến cáo cần phải xét nghiệm mẫu tiếp theo sau 2 tuần. Nếu nồng độ kháng thể IgG kháng CMV vẫn ổn định, tình trạng nhiễm trùng nguyên phát có thể được loại trừ.
Kết quả Elecsys CMV IgG phải luôn đánh giá kèm theo bệnh sử, thăm khám lâm sàng và các kiểm tra khác, ví dụ kết quả kháng thể IgM đặc hiệu CMV, ái lực kháng thể IgG kháng CMV.
Phải cẩn trọng trong biện luận các kết quả thu được ở bệnh nhân HIV, bệnh nhân đang điều trị ức chế miễn dịch, hoặc ở bệnh nhân có các rối loạn khác dẫn đến ức chế miễn dịch.
Các mẫu từ trẻ sơ sinh, cuống rốn, bệnh nhân trước khi cấy ghép hoặc các dịch thể khác ngoài huyết thanh và huyết tương, như nước tiểu, nước bọt hoặc dịch màng ối chưa được xét nghiệm.
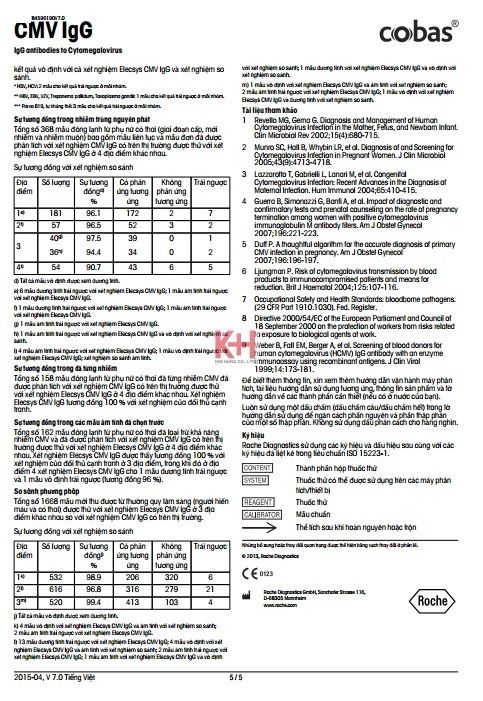
Trong số 142 mẫu dương tính nằm trong khoảng đo, hiệu ứng mẫu phẩm có nồng độ cao không ảnh hưởng đến kết quả xét nghiệm (không tăng tín hiệu sau pha loãng). Tuy nhiên, khả năng xảy ra hiệu ứng mẫu phẩm có nồng độ cao không thể loại trừ trong các đoàn hệ khác.
Xét nghiệm không bị ảnh hưởng bởi vàng da (bilirubin < 1129 μmol/L hoặc < 66 mg/dL), tán huyết (Hb < 0.310 mmol/L hoặc < 0.500 g/dL), lipid huyết (Intralipid < 2000 mg/dL) và biotin (< 246 nmol/L hoặc < 60 ng/mL).
Tiêu chuẩn: Độ phục hồi trung bình của mẫu dương tính trong khoảng ± 20 % giá trị huyết thanh.
Ở bệnh nhân dùng liều cao biotin (ngh˜ia là > 5 mg/ngày), không nên lấy mẫu cho đến ít nhất 8 giờ sau khi dùng liều biotin cuối.
Kết quả xét nghiệm không bị nhiễu bởi các yếu tố thấp khớp với nồng độ lên đến 1500 IU/mL.
Thử nghiệm in vitro được tiến hành trên 18 loại dược phẩm thường sử dụng và cả ganciclovir và valganciclovir. Không có hiện tượng nhiễu tới xét nghiệm.
Trong một số hiếm trường hợp, nhiễu có thể xảy ra do nồng độ kháng thể kháng các thành phần miễn dịch, kháng streptavidin hay ruthenium quá cao của mẫu phẩm phân tích. Xét nghiệm đã được thiết kế phù hợp để giảm thiểu các hiệu ứng này.
Với mục tiêu chẩn đoán, kết quả xét nghiệm cần được đánh giá kèm theo bệnh sử, thăm khám lâm sàng và các phát hiện khác.
Giới hạn đo và khoảng đo
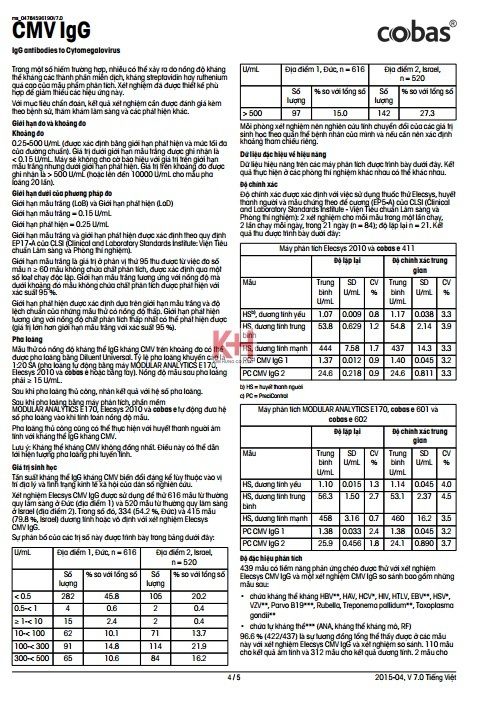
- Khoảng đo: 0.25-500 U/mL (được xác định bằng giới hạn phát hiện và mức tối đa của đường chuẩn). Giá trị dưới giới hạn mẫu trắng được ghi nhận là < 0.15 U/mL. Máy sẽ không cho cờ báo hiệu với giá trị trên giới hạn mẫu trắng nhưng dưới giới hạn phát hiện. Giá trị trên khoảng đo được ghi nhận là > 500 U/mL (hoặc lên đến 10000 U/mL cho mẫu pha loãng 20 lần).
Giới hạn dưới của phương pháp đo
Giới hạn mẫu trắng (LoB) và Giới hạn phát hiện (LoD)
Giới hạn mẫu trắng= 0.15 U/mL
Giới hạn phát hiện = 0.25 U/mL
Giới hạn mẫu trắng và giới hạn phát hiện được xác định theo quy định EP17-A của CLSI (Clinical and Laboratory Standards Institute:
Viện Tiêu chuẩn Lâm sàng và Phòng thí nghiệm).
Giới hạn mẫu trắng là giá trị ở phân vị thứ 95 thu được từ việc đo số mẫu n ≥ 60 mẫu không chứa chất phân tích, được xác định qua một số loạt chạy độc lập. Giới hạn mẫu trắng tương ứng với nồng độ mà dưới khoảng đó mẫu không chứa chất phân tích được phát hiện với xác suất 95 %.
Giới hạn phát hiện được xác định dựa trên giới hạn mẫu trắng và độ lệch chuẩn của những mẫu thử có nồng độ thấp. Giới hạn phát hiện tương ứng với nồng độ chất phân tích thấp nhất có thể phát hiện được (giá trị lớn hơn giới hạn mẫu trắng với xác suất 95 %).
Pha loãng
Mẫu thử có nồng độ kháng thể IgG kháng CMV trên khoảng đo có thể được pha loãng bằng Diluent Universal. Tỷ lệ pha loãng khuyến cáo là 1:20 (pha loãng tự động bằng máy MODULAR ANALYTICS E170, Elecsys 2010 và cobas e hoặc bằng tay). Nồng độ mẫu sau pha loãng phải ≥ 15 U/mL. Sau khi pha loãng thủ công, nhân kết quả với hệ số pha loãng. Sau khi pha loãng bằng máy phân tích, phần mềm MODULAR ANALYTICS E170, Elecsys 2010 và cobas e tự động đưa hệ số pha loãng vào khi tính toán nồng độ mẫu.
Pha loãng thủ công cũng có thể thực hiện với huyết thanh người âm tính với kháng thể IgG kháng CMV.
Lưu ý: Kháng thể kháng CMV không đồng nhất. Điều này có thể dẫn tới hiện tượng pha loãng phi tuyến tính.
http://kimhung.vn/vi/shops/Bang-chi-dau-xuong-Elecsys/Hoa-chat-mien-dich-Roche-1710/
TÀI LIỆU CMV IGG



HẾT HẠN
| Mã số : | 12205410 |
| Địa điểm : | Hồ Chí Minh |
| Hình thức : | Cần bán |
| Tình trạng : | Hàng mới |
| Hết hạn : | 15/04/2017 |
| Loại tin : | Thường |







Bình luận