T-Uptake: Khả Năng Kết Hợp Thyroxine
Liên hệ
Hà Nội

Catalog Number: 11731394122
Hóa chất có thể được sử dụng trên máy: Elecsys 2010, Modular analytics E170, cobas e 411, cobas e 601
Mục đích sử dụng
Xét nghiệm miễn dịch in vitro dùng để định lượng khả năng kết hợp thyroxine (TBC hay T4‑uptake) trong huyết thanh và huyết tương người.
Xét nghiệm miễn dịch điện hóa phát quang “ECLIA” được dùng cho các máy xét nghiệm miễn dịch Elecsys và cobas e.
Tóm tắt
Nội tiết tố tuyến giáp thyroxine (T4) là thành phần sinh lý của vòng điều hòa tuyến giáp và có tác động trên chuyển hóa chung. Định lượng nồng độ T4 quan trọng trong việc chẩn đoán trong phòng xét nghiệm để phân biệt giữa bình giáp, cường giáp và nhược giáp.
Vì phần lớn thyroxine gắn với protein vận chuyển (TBG, tiền albumin và albumin), việc xác định thyroxine toàn phần chỉ cung cấp thông tin chính xác khi khả năng gắn kết thyroxine trong huyết thanh là bình thường. Nội tiết tố tuyến giáp tự do trong trạng thái cân bằng với nội tiết tố gắn với protein mang. Một thay đổi trong nồng độ TBG có thể dẫn tới nồng độ T4 toàn phần đo được tăng hoặc giảm mặc dù nồng độ T4 tự do vẫn nằm trong khoảng bình giáp.
Hiệu năng của xét nghiệm T‑uptake hoặc TBC cung cấp một phép đo cho các vị trí gắn kết thyroxine còn trống.
Xác định chỉ số thyroxine tự do (fT4I) từ thương số giữa T4 toàn phần và TBI (chỉ số gắn kết thyroxine = kết quả định lượng T‑uptake) có tính đến thay đổi trong protein mang nội tiết tố tuyến giáp và nồng độ thyroxine.
Xét nghiệm Elecsys T‑Uptake là một phương pháp miễn dịch định lượng T‑uptake (TBC), trong đó T4 ngoại sinh được thêm vào để bão hòa TBG
Nguyên lý xét nghiệm
Nguyên lý cạnh tranh cải tiến. Tổng thời gian xét nghiệm: 18 phút. ▪ Thời kỳ ủ đầu tiên: 15 µL mẫu thử, T4 ngoại sinh, và T4‑polyhapten đánh dấu biotin. T4 chiếm giữ các vị trí gắn kết tự do trong mẫu huyết thanh.
▪ Thời kỳ ủ thứ hai: Sau khi thêm kháng thể đặc hiệu kháng T4 đánh dấu phức hợp rutheniuma), polyhapten và dẫn xuất kháng thể phản ứng với nhau tạo thành một phức hợp, nồng độ của phức hợp tỷ lệ nghịch với nồng độ của T4 ngoại sinh dư thừa. Phức hợp miễn dịch này trở nên gắn kết với vi hạt phủ streptavidin thêm vào thông qua sự tương tác giữa biotin và streptavidin.
▪ Hỗn hợp phản ứng được chuyển tới buồng đo, ở đó các vi hạt đối từ được bắt giữ trên bề mặt của điện cực. Những thành phần không gắn kết sẽ bị thải ra ngoài buồng đo bởi dung dịch ProCell/ProCell M. Cho điện áp vào điện cực sẽ tạo nên sự phát quang hóa học được đo bằng bộ khuếch đại quang tử.
▪ Các kết quả được xác định thông qua một đường chuẩn xét nghiệm trên máy được tạo nên bởi xét nghiệm 2 điểm chuẩn.
a) Tris(2,2''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''-bipyridyl)ruthenium(II)-complex (Ru(bpy) )
Thuốc thử - dung dịch tham gia xét nghiệm
Bộ thuốc thử được dán nhãn T UP.
M Vi hạt phủ Streptavidin (nắp trong), 1 chai, 12 mL: Vi hạt phủ Streptavidin 0.72 mg/mL; chất bảo quản.
R1 Poly-T4~biotin (nắp xám), 1 chai, 18 mL: T4 polyhapten đánh dấu biotin 70 ng/mL; thyroxine 60 ng/mL; đệm phosphate 100 mmol/L, pH 7.0; chất bảo quản.
R2 Anti‑T4‑Ab~Ru(bpy) (nắp đen), 1 chai, 18 mL: Kháng thể đa dòng kháng T4 (cừu) đánh dấu phức hợp ruthenium 120 ng/mL; đệm phosphate 100 mmol/L, pH 7.0; chất bảo quản.
Thận trọng và cảnh báo
Dùng trong chẩn đoán in vitro.
Áp dụng các cảnh báo thông thường cần thiết cho việc xử lý các loại thuốc thử phòng thí nghiệm.
Loại bỏ các chất thải tuân theo hướng dẫn của địa phương.
Bảng dữ liệu an toàn hóa chất có sẵn để cung cấp cho chuyên viên sử dụng khi có yêu cầu.
Tránh để các dung dịch thuốc thử và các mẫu (mẫu xét nghiệm, mẫu chuẩn và mẫu chứng) bị tạo bọt.
Sử dụng thuốc thử
Các thuốc thử trong hộp được đựng trong một bộ các chai sẵn sàng để sử dụng và không thể tách riêng.
Máy phân tích tự động đọc mã vạch trên nhãn thuốc thử và ghi nhận tất cả thông tin cần thiết cho việc chạy thuốc thử.
Bảo quản và độ ổn định
Bảo quản ở 2‑8 °C.
Không trữ đông.
Đặt hộp thuốc thử Elecsys theo hướng thẳng đứng nhằm đảm bảo tính hữu dụng của toàn bộ các vi hạt trong khi trộn tự động trước khi sử dụng.
Lấy và chuẩn bị mẫu
Chỉ những mẫu được liệt kê dưới đây đã được thử nghiệm và được chấp nhận.
Huyết thanh không pha loãng được lấy bằng cách sử dụng các ống chuẩn lấy mẫu hoặc các ống chứa gel tách.
Huyết tương chống đông bằng Li-, Na-, NH ‑heparin, K3‑EDTA, natri citrate và natri fluoride/kali oxalate (không pha loãng).
Tiêu chuẩn: Độ phục hồi nằm trong khoảng 90‑110 % giá trị huyết thanh hoặc hệ số góc 0.9‑1.1 + tung độ gốc trong khoảng < ± 2x độ nhạy phân tích (LDL) + hệ số tương quan > 0.95.
Mẫu ổn định trong 8 ngày ở 2‑8 °C, 3 tháng ở -20 °C. Chỉ đông lạnh một lần.
Các loại mẫu phẩm được liệt kê đã được thử nghiệm cùng với bộ các ống nghiệm lấy mẫu chọn lọc, có bán trên thị trường vào thời điểm xét nghiệm, nghĩa là không phải tất cả các ống lấy mẫu của các nhà sản xuất đều được thử nghiệm. Các bộ ống chứa mẫu của các nhà sản xuất khác nhau có thể làm từ những vật liệu khác nhau có khả năng
ảnh hưởng đến kết quả xét nghiệm trong một số trường hợp. Khi xử lý mẫu trong các ống chính (ống chứa mẫu), phải tuân theo hướng dẫn của nhà sản xuất ống.
Ly tâm các mẫu có kết tủa trước khi thực hiện xét nghiệm.
Không sử dụng các mẫu bị bất hoạt bởi nhiệt.
Không sử dụng mẫu thử và mẫu chứng được ổn định bằng azide
Đảm bảo nhiệt độ của các mẫu bệnh phẩm, mẫu chuẩn và mẫu chứng ở 20‑25 °C trước khi tiến hành đo.
Do có khả năng xảy ra các hiệu ứng bay hơi, các mẫu bệnh phẩm, mẫu chuẩn và mẫu chứng trên các thiết bị phân tích phải được đo trong vòng 2 giờ.
Xét nghiệm
Để tối ưu hiệu năng xét nghiệm, nên tuân theo hướng dẫn trong tài liệu này cho các máy tương ứng. Tham khảo hướng dẫn vận hành cho từng xét nghiệm đặc hiệu tương ứng.
Thiết bị tự động trộn các vi hạt trước khi sử dụng. Máy đọc thông số đặc hiệu của xét nghiệm trên mã vạch của thuốc thử. Trong trường hợp ngoại lệ nếu máy không đọc được mã vạch, hãy nhập chuỗi 15 con số vào.
Đưa thuốc thử đang lạnh về khoảng 20 °C và đặt vào khay chứa thuốc thử (20 °C) trên máy phân tích. Tránh tạo bọt. Hệ thống sẽ tự động điều hòa nhiệt độ của thuốc thử và đóng/mở nắp chai.
Chuẩn
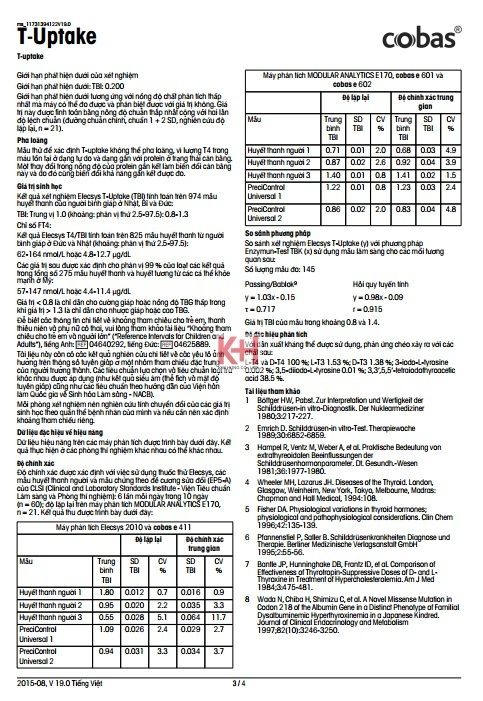
Thông tin ghi nhận dữ liệu: Phương pháp này đã được chuẩn hóa sử dụng dàn mẫu huyết thanh người đã thử nghiệm lâm sàng với TBI trung bình là 1.0. Kết quả đo được biểu thị dưới dạng chỉ số. Giá trị bình thường được xác định trong một nghiên cứu trên nhóm huyết thanh bình thường và đặt mặc định ở 1.
Nhãn của từng hộp thuốc thử Elecsys có mã vạch chứa các thông tin đặc hiệu để chuẩn cho từng lô thuốc thử riêng biệt. Đường chuẩn chính đã được xác định trước sẽ được tái lập trên máy phân tích bằng cách dùng chất chuẩn CalSet có liên quan.
Tần suất chuẩn định: Cần thực hiện chuẩn mỗi lô thuốc thử với hộp thuốc thử mới (nghĩa là không quá 24 giờ từ khi hộp thuốc thử được đăng ký trên máy phân tích). Thực hiện chuẩn lại khi:
▪ sau 1 tháng (28 ngày) nếu sử dụng các hộp thuốc thử cùng lô
▪ sau 7 ngày (nếu sử dụng cùng hộp thuốc thử đó)
▪ khi cần thiết: ví dụ: khi kết quả mẫu chứng nằm ngoài thang Kiểm tra chất lượng
Để kiểm tra chất lượng, sử dụng PreciControl Universal.
Các loại mẫu chứng thích hợp khác cũng có thể được sử dụng.
Chạy các mẫu chứng với nồng độ khác nhau tối thiểu là một lần cho mỗi 24 giờ khi xét nghiệm vẫn đang sử dụng, một lần với mỗi hộp thuốc thử và sau mỗi lần chuẩn.
Khoảng cách giữa các lần chạy mẫu chứng và giá trị giới hạn nên tùy thuộc vào yêu cầu riêng của từng phòng thí nghiệm. Kết quả mẫu chứng phải nằm trong thang. Mỗi phòng xét nghiệm nên thiết lập các biện pháp hiệu chỉnh nếu các giá trị mẫu chứng nằm ngoài thang đo.
Tuân thủ các quy định chính phủ và hướng dẫn của địa phương về kiểm tra chất lượng.
Tính toán
Máy phân tích sẽ tự động tính toán nồng độ T‑uptake (TBC) trong mỗi mẫu đo dưới dạng giá trị TBI.
Để có thêm thông tin về chức năng tuyến giáp (cũng liên quan đến giá trị T4), cần xác định chỉ số thyroxine tự do.
fT4I = T4 : TBI
Yếu tố hạn chế - ảnh hưởng
Xét nghiệm không bị ảnh hưởng bởi vàng da (bilirubin < 701 µmol/L hoặc < 41 mg/dL), tán huyết (Hb < 1.2 mmol/L hoặc < 2 g/dL), lipid huyết (Intralipid < 2000 mg/dL) và biotin (< 164 nmol/L hoặc < 40 ng/mL).
Tiêu chuẩn: Độ phục hồi trong khoảng ± 10 % giá trị ban đầu.
Ở bệnh nhân dùng liều cao biotin (nghĩa là > 5 mg/ngày), không nên lấy mẫu cho đến ít nhất 8 giờ sau khi dùng liều biotin cuối.
Kết quả xét nghiệm không bị nhiễu bởi các yếu tố thấp khớp với nồng độ lên đến 339 IU/mL và mẫu từ bệnh nhân thẩm phân máu.
Thử nghiệm in vitro được tiến hành trên 26 loại dược phẩm thường sử dụng. Không có hiện tượng nhiễu tới xét nghiệm.
Xét nghiệm không được tiến hành trên những bệnh nhân đang điều trị với thuốc hạ lipid có chứa D‑T4. Nếu cần kiểm tra chức năng tuyến giáp ở các bệnh nhân này, đầu tiên nên ngưng việc điều trị trong 4‑6 tuần để tình trạng sinh lý được thiết lập trở lại
Các tự kháng thể kháng nội tiết tố tuyến giáp có thể gây nhiễu kết quả xét nghiệm.
Bất thường về protein gắn có thể gặp trong hội chứng FDH (cao thyroxine trong máu do rối loạn albumin có tính gia đình), trong một số điều kiện cụ thể có thể gây giá trị sai lệch so với kết quả trông đợi.8
Trong một số hiếm trường hợp, nhiễu có thể xảy ra do nồng độ kháng thể kháng kháng thể đặc hiệu kháng chất phân tích, kháng streptavidin hay ruthenium quá cao của mẫu phẩm phân tích. Xét nghiệm đã được thiết kế phù hợp để giảm thiểu các hiệu ứng này.
Với mục tiêu chẩn đoán, kết quả xét nghiệm cần được đánh giá kèm theo bệnh sử, thăm khám lâm sàng và các phát hiện khác.
Giới hạn đo và khoảng đo
Khoảng đo
TBI: 0.200‑1.90
Giá trị dưới giới hạn phát hiện dưới được ghi nhận là < 0.200 TBI. Giá trị trên khoảng đo được ghi nhận là > 1.90 TBI.
Giới hạn dưới của phương pháp đo
Giới hạn phát hiện dưới của xét nghiệm
Giới hạn phát hiện dưới: TBI: 0.200
Giới hạn phát hiện dưới tương ứng với nồng độ chất phân tích thấp nhất mà máy có thể đo được và phân biệt được với giá trị không. Giá trị này được tính toán bằng nồng độ chuẩn thấp nhất cộng với hai lần độ lệch chuẩn (đường chuẩn chính, chuẩn 1 + 2 SD, nghiên cứu độ lặp lại, n = 21).
Pha loãng
Mẫu thử để xác định T‑uptake không thể pha loãng, vì lượng T4 trong máu tồn tại ở dạng tự do và dạng gắn với protein ở trạng thái cân bằng.
Một thay đổi trong nồng độ của protein gắn kết làm biến đổi cân bằng này và do đó cũng biến đổi khả năng gắn kết được đo.
http://kimhung.vn/vi/shops/Bang-chi-dau-xuong-Elecsys/Hoa-chat-mien-dich-Roche-1710/
TÀI LIỆU T-UPTAKE



TÀI LIỆU T-UPTAKE CALSET

HẾT HẠN
| Mã số : | 12208864 |
| Địa điểm : | Hồ Chí Minh |
| Hình thức : | Cần bán |
| Tình trạng : | Hàng mới |
| Hết hạn : | 14/06/2017 |
| Loại tin : | Thường |







Bình luận